近日,美国北卡罗来纳大学教堂山分校Lineberger综合癌症中心的JennyP.Y.Ting团队与YuliyaPylayeva-Gupta实验室合作,首次揭示STING通路的新型免疫逃逸机制。这项研究于10月5日在线发表于《自然》杂志。
近年来,免疫疗法已经彻底改变了癌症治疗领域,但仍有相当一部分患者不会对免疫疗法产生反应。在冷肿瘤或者实体瘤中,预先存在的抗肿瘤免疫群体不足,是免疫疗法治疗反应的重要障碍。
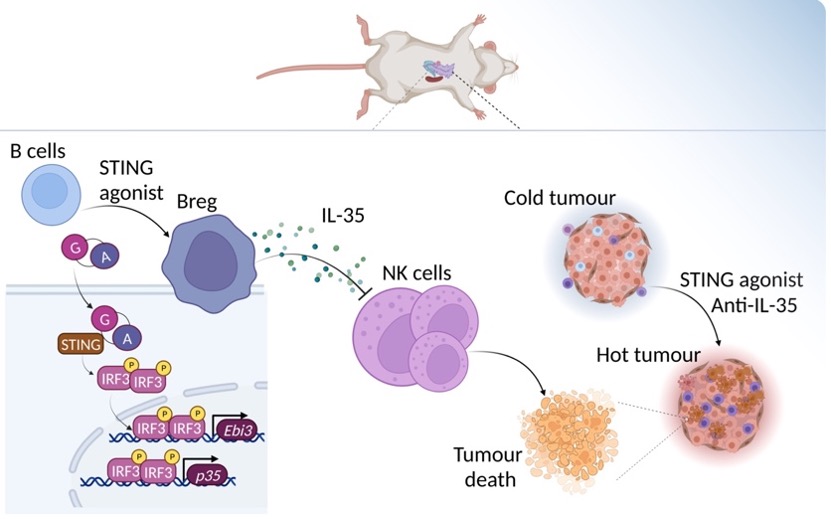
cGAS/STING通路是识别放疗、化疗过程中产生的损伤相关分子以及细胞内异常DNA的重要途径之一。临床前研究表明,STING信号活化可激活抗肿瘤杀伤性细胞的免疫应答反应,促进大量细胞因子,趋化因子和一型干扰素等的表达。因此STING激动剂广泛用于新型抗肿瘤药物的研究和开发。
然而,临床试验表明,对肿瘤单独应用STING激动剂无明显受益。当结合T细胞免疫检查点的PDL1或PD1的阻断抗体时,抗肿瘤效应收效甚微。迄今尚未成功研发出临床适用的STING激动剂,肿瘤患者对STING激动剂免疫疗法产生抵抗的机制尚不清楚,亟需进一步阐明。
“我们通过对肿瘤内免疫细胞类群的分析,发现系统性递送STING激动剂可在实体瘤局部累积大量的调节性B细胞,通过基因剥夺、无偏差测序、抗体阻断等论证方法,证明了对STING激动剂可促进抑制性IL-35+B细胞在肿瘤局部扩增,最终阻碍NK效应细胞的增殖,削弱了后者抗肿瘤免疫应答。”本文共同第一作者、美国北卡罗来纳大学教堂山分校Lineberger综合癌症中心博士后李思睿介绍。
她告诉《中国科学报》,“STING激动剂与抑制性细胞因子IL-35阻断抗体联合应用作为癌症免疫疗法,为基于STING激动剂的联合治疗提供了全新思路,有望为肿瘤患者带来福音。”
相关论文信息:
https://doi.org/10.1038/s41586-022-05254-3



